BioNtech退货双抗的思考
近日,BioNtech在其二季度财报中宣布将不参与合作项目BNT311/GEN1046(acasunlimab)的后续开发。III期临床将由合作方Genmab继续推进。

虽然此前在ASCO上披露的acasunlimab数据确实很令人鼓舞,但根据BioNtech的说法,是出于项目组合战略的顾虑,而选择“退货”的。
实际上情况也确实如此,acasunlimab无论对比同赛道竞品,还是所处BioNtech管线中的位置都比较尴尬。
想要克服给药窗口的acasunlimab
acasunlimab的诞生主要是为了克服4-1BB抗体较强的肝毒性。早期的4-1BB单抗虽然在临床前阶段展现出一些很有希望的信号,但进入临床后,就遭遇了肝毒性的治疗窗口。
4-1BB强激动抗体Urelumab就是典型,虽然抗肿瘤效果良好,但很快发生了两起由肝毒性引起的致命性不良事件,这导致BMS放弃了该管线。
后来辉瑞试图开发弱激动抗体Utomilumab,安全性确实提高了,但是抗肿瘤活性就不尽如人意,因此也被放弃。
开发双抗和联合用药就成为了4-1BB靶点的未来方向。
而PD-L1/4-1BB双抗acasunlimab旨在通过条件性4-1BB刺激增强T细胞和NK细胞功能,同时组成性阻断PD-1/PD-L1抑制轴。同时靶向双靶点能够尽可能地提升治疗窗口。
肝毒性方面肯定是优于Urelumab的,但是转氨酶升高事件依旧存在,且存在III级以上事件,在其此前在非小细胞肺癌适应症中公布的II期临床分为了三组,单药,联用K药Q3W组(3周一次给药),还有联用K药Q6W组,三组均出现了肝毒性报告。其中联用K药的Q3W组的肝毒性报告最多,Q6W组的疗效数据最好,肝毒性报告相对Q3W较少,但是仍然有3级以上事件。
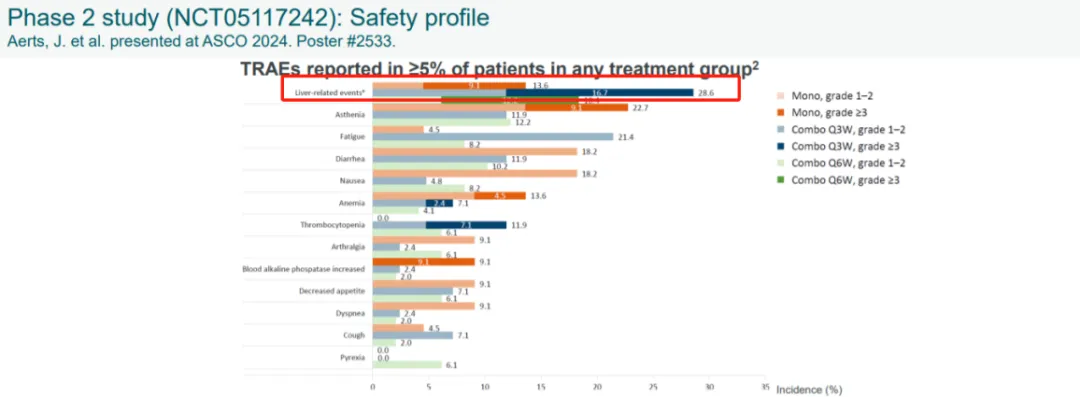
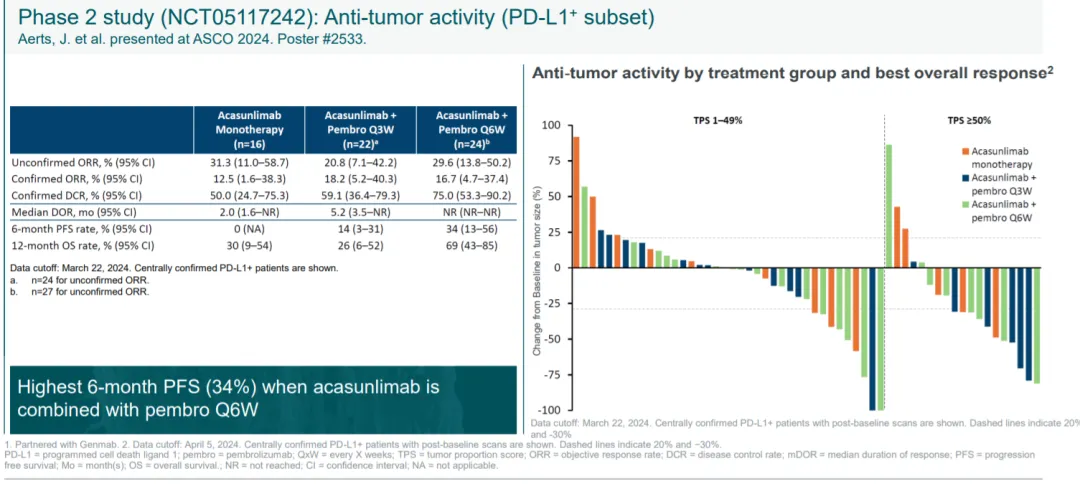
疗效方面的数据虽然令人鼓舞,但是也有些疑惑,未确认的ORR似乎较多。6QW组可能是未来III期临床的开发方向。
处于赛道劣势的acasunlimab
acasunlimab此前在I期临床中尝试了直肠癌,卵巢癌,胰腺癌,非小细胞肺癌等多个癌种,但是只有非小细胞肺癌中的疗效较为优异。然而关键的是非小细胞肺癌这一赛道BioNtech还有另外一条管线BNT316/ONC-392,而且疗效也非常不错,机制上有别于传统CTLA-4+PD-1/L1的组合,是新型的CTLA-4单抗。
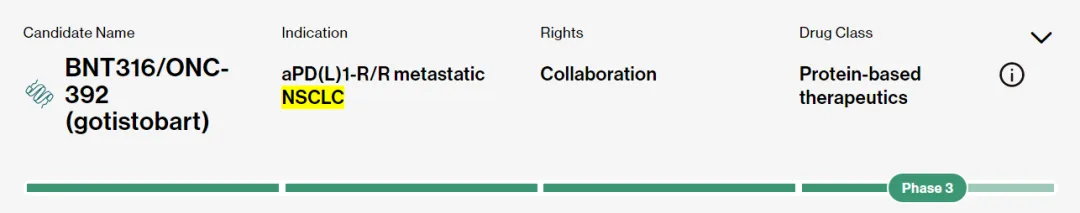
采用的是全新的理论和机制:传统CTLA-4单抗与CTLA-4的结合牢固,易导致Treg细胞表面的CTLA-4分子水平下降,从而引发严重的免疫相关不良反应。相比之下,ONC-392在溶酶体酸性环境中与CTLA-4解耦的特性,使得其副作用控制更为出色。在PRESERVE-001试验中,ONC-392联合K药治疗的患者中,仅发生了3例3级的免疫相关不良事件,未发生4级或5级的不良反应,安全性十分良好。这对于传统CTLA-4+PD-1/L1组合而带来的副作用可能是一种降维打击。疗效数据其实也可圈可点,2023年8月公布的数据显示,达到了22.2%的确认ORR。BioNtech专门为ONC-392开展了非小细胞肺癌的III期临床,其他相关癌种的临床也在推进,这么来看,同样打算开展非小细胞肺癌III期临床的acasunlimab反而显得多余。

有趣的是,找准赛道的同样可以反映在同靶点竞品上。同靶点赛道中,维立志博的LBL-024就选择了一项竞争没有那么激烈,且确实存在大量未满足临床需求的肺外神经内分泌癌(EP-NEC)上。
神经内分泌癌本身少见,但是两线治疗失败的预后较差,治疗选择较少,因此确实存在大量尚未满足的临床需求。
而今年ASCO的数据表明LBL-024的安全性和有效性。不良事件多为1-2级。在15mg/kg剂量下,二线治疗EP-NEC的客观缓解率(ORR)为37.5%,疾病控制率(DCR)为50.0%,且在0.8~15mg/kg的剂量范围内均观察到强力抗肿瘤活性。因此,LBL-024有望成为首款EP-NEC二线治疗进展后标准治疗方案。
写在最后
总的来说,acasunlimab被退货可能源于自身定位在BioNtech的管线中出现重合,以及同适应症赛道竞争并没有明显优势,反而有肝毒性担忧导致的。






 我要投稿
我要投稿





